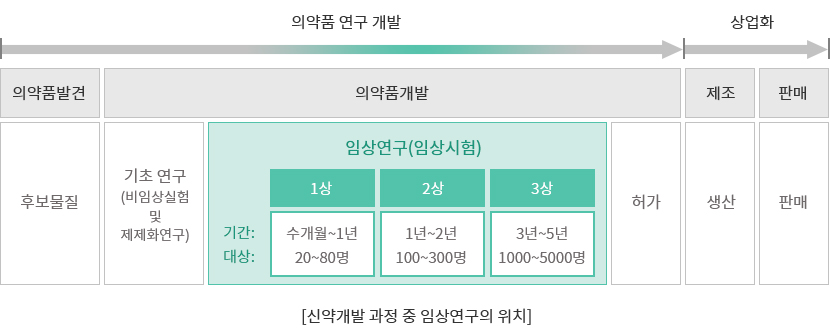
새로운 치료제 개발을 위해 한 개의 후보물질이 발견된 이후 동물 등을 이용한 다양한 실험실적 연구를 수행하게 됩니다. 이후 해당 치료제의 안전성 및 유효성을 확인하기 위해 사람을 대상으로 한 임상시험에서 여러 단계를 거치게 되는데 각 단계별로 긍정적 결과가 도출될 경우에 다음 단계로 진입하게 됩니다. 이러한 모든 절차가 완료된 이후 허가 및 상업화의 과정을 거치게 됩니다.
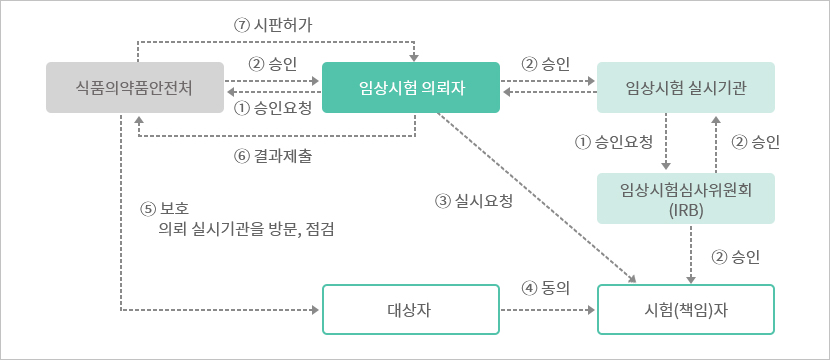
임상시험승인절차
-
1
임상시험의뢰자는 임상시험계획서를 작성하여 식품의약품안전처와 실시기관 내 임상시험심사위원회(IRB)에 승인신청을 합니다.
-
2
식품의약품안전처와 실시기관 내 임상시험심사위원회(IRB)에서는 임상시험계획서를 세밀히 검토 후 승인여부를 결정합니다.
-
3
임상시험의뢰자는 신약후보물질에 대한 안전성과 유효성을 검증하기 위해 시험책임자에게 임상시험 실시를 요청합니다.
-
4
시험책임자는 대상자에게 임상시험에 대해 충분히 설명한 후 동의서를 받으며, 임상시험계획서에 따라 과학적이고 윤리적인 임상시험을 진행합니다.
-
5
임상시험과 관련하여 식품의약품안전처는 임상시험 실시기관, 임상시험의뢰자, 시험책임자등에 대한 실태조사를 실시할 수 있습니다.
-
6
식품의약품안전처의 신약후보물질의 안전성과 유효성을 평가하여 시판허가 여부를 결정하고, 시판허가를 받은 후 판매할 수 있습니다.